jueves, 17 de noviembre de 2016
GIFS Reacciones Químicas.
Etiquetas:
ambiental,
ambiente,
carbono,
chemistry,
concentración,
cristalización,
destilación,
disoluciones,
GIFS,
industrial,
laboratorio,
orgánica,
química,
químico,
ramas,
reacción,
reacciones,
solución,
soluciones
Solubilidad.
Solubilidad.
En química, la solubilidad mide la capacidad de una determinada sustancia para disolverse en un líquido.
Algunos líquidos, tales como agua y alcohol, pueden ser disueltos en cualquier proporción en otro solvente. Sin embargo, el azúcar tiene un límite de solubilidad ya que al agregar cierta cantidad adicional en una solución esta dejará de solubilizarse, llamándose a esta solución saturada.
Es la proporción en que una cantidad determinada de una sustancia se disolverá en una cantidad determinada de un líquido, a una temperatura dada.
En términos generales, es la facilidad con que un sólido puede mezclarse homogéneamente con el agua para proporcionar una solución química.
Concepto
La solubilidad es la mayor cantidad de soluto (gramos de sustancia) que se puede disolver en 100 gramos (g). de disolvente a una temperatura fija, para formar una disolución saturada en cierta cantidad de disolvente.
Las sustancias no se disuelven en igual medida en un mismo disolvente. Con el fin de poder comparar la capacidad que tiene un disolvente para disolver un producto dado, se utiliza una magnitud que recibe el nombre de solubilidad .
La capacidad de una determinada cantidad de líquido para disolver una sustancia sólida no es ilimitada. Añadiendo soluto a un volumen dado de disolvente se llega a un punto a partir del cual la disolución no admite más soluto (un exceso de soluto se depositaría en el fondo del recipiente). Se dice entonces que está saturada.
Pues bien, la solubilidad de una sustancia respecto de un disolvente determinado es la concentración que corresponde al estado de saturación a una temperatura dada.
Las solubilidades de sólidos en líquidos varían mucho de unos sistemas a otros. Así a 20º C la solubilidad del cloruro de sodio (NaCl) en agua es 6 M (molar) y en alcohol etílico (C 2 H 6 O), a esa misma temperatura, es 0,009 M (molar). Cuando la solubilidad es superior a 0,1 M (molar) se suele considerar la sustancia como soluble en el disolvente considerado; por debajo de 0,1 M (molar) se considera como poco soluble o incluso como insoluble si se aleja bastante de este valor de referencia.
La solubilidad depende de la temperatura; de ahí que su valor vaya siempre acompañado del de la temperatura de trabajo. En la mayor parte de los casos, la solubilidad aumenta al aumentar la temperatura.
Factores que determinan la solubilidad
Solubilidad en líquidos: al elevar la temperatura aumenta la solubilidad del soluto gas en el líquido debido al aumento de choques entre moléculas contra la superficie del líquido. También ocurre lo mismo con la presión.
Solubilidad de líquidos en líquidos: Al aumentar la temperatura aumenta la solubilidad de líquidos en líquidos. En este caso la solubilidad no se ve afectada por la presión.
Solubilidad de sólidos en líquidos: la variación de solubilidad está relacionada con el calor absorbido o desprendido durante el proceso de disolución. Si durante el proceso de disolución se absorbe calor la solubilidad crece con el aumento de la temperatura, y por el contrario, si se desprende calor durante el proceso de disolución, la solubilidad disminuye con la elevación de temperatura. La presión no afecta a la solubilidad en este caso.
Unidades de medida
Puesto que la solubilidad es la máxima concentración que puede alcanzar un soluto, se medirá en las mismas unidades que la concentración.
Es habitual medir en gramos de soluto por litro de disolución (g/l) o en gramos de soluto por cada 100 cc de disolución (%).
Aunque la unidad de medida se parezca a la de la densidad, no es una medida de densidad. En la densidad, masa y volumen se refieren al mismo cuerpo. En la solubilidad, la masa es de soluto y el volumen es de la disolución, de la mezcla de soluto y disolvente.
Etiquetas:
chemistry,
concentración,
disoluciones,
industrial,
laboratorio,
laboratory,
orgánica,
química,
químico,
solubilidad,
solución,
soluciones
Concentración de la Solución.
Concentración de la solución.
Mayor o menor concentración
Para saber exactamente la cantidad de soluto y de solvente de una disolución se utiliza una magnitud denominada concentración .
Dependiendo de su concentración , las disoluciones se clasifican en diluidas, concentradas, saturadas, sobresaturadas.
Diluidas : si la cantidad de soluto respecto del solvente es pequeña. Ejemplo: una solución de 1 gramo de sal de mesa en 100 gramos de agua.
Concentradas : si la proporción de soluto con respecto del solvente es grande. Ejemplo: una disolución de 25 gramos de sal de mesa en 100 gramos de agua.
Saturadas : se dice que una disolución está saturada a una determinada temperatura cuando no admite más cantidad de soluto disuelto. Ejemplo: 36 gramos de sal de mesa en 100 gramos de agua a 20º C.
Si intentamos disolver 38 gramos de sal en 100 gramos de agua, sólo se disolvería 36 gramos y los 2 gramos restantes permanecerán en el fondo del vaso sin disolverse.
Sobresaturadas : disolución que contiene mayor cantidad de soluto que la permitida a una temperatura determinada. La sobresaturación se produce por enfriamientos rápidos o por descompresiones bruscas. Ejemplo: al sacar el corcho a una botella de refresco gaseoso.
Modo de expresar las concentraciones
Ya sabemos que la concentración de las soluciones es la cantidad de soluto contenido en una cantidad determinada de solvente o solución. También debemos aclarar que los términos diluida o concentrada expresan concentraciones relativas.
Las unidades de concentración en que se expresa una solución o disolución pueden clasificarse en unidades físicas y en unidades químicas .
Unidades físicas de concentración
Las unidades físicas de concentración están expresadas en función del peso y del volumen, en forma porcentual, y son las siguientes:
a) Tanto por ciento peso/peso %P/P = (cantidad de gramos de soluto) / (100 gramos de solución)
b) Tanto por ciento volumen/volumen %V/V = (cantidad de cc de soluto) / (100 cc de solución)
c) Tanto por ciento peso/volumen % P/V =(cantidad de gr de soluto)/ (100 cc de solución)
a) Porcentaje peso a peso (% P/P): indica el peso de soluto por cada 100 unidades de peso de la solución.
b) Porcentaje volumen a volumen (% V/V): se refiere al volumen de soluto por cada 100 unidades de volumen de la solución.
c) Porcentaje peso a volumen (% P/V): indica el número de gramos de soluto que hay en cada 100 ml de solución.
Soluciones o disoluciones químicas.
Soluciones o disoluciones químicas.
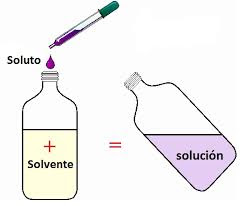
Una solución (o disolución) es una mezcla de dos o más componentes , perfectamente homogénea ya que cada componente se mezcla íntimamente con el otro, de modo tal que pierden sus características individuales. Esto último significa que los constituyentes son indistinguibles y el conjunto se presenta en una sola fase (sólida, líquida o gas) bien definida.
Una solución que contiene agua como solvente se llama solución acuosa .
Si se analiza una muestra de alguna solución puede apreciarse que en cualquier parte de ella su composición es constante.
Entonces, reiterando, llamaremos solución o disolución a las mezclas homogéneas que se encuentran en fase líquida . Es decir, las mezclas homogéneas que se presentan en fase sólida, como las aleaciones (acero, bronce, latón) o las que se hallan en fase gaseosa (aire, humo, etc.) no se les conoce como disoluciones.
Entonces, reiterando, llamaremos solución o disolución a las mezclas homogéneas que se encuentran en fase líquida . Es decir, las mezclas homogéneas que se presentan en fase sólida, como las aleaciones (acero, bronce, latón) o las que se hallan en fase gaseosa (aire, humo, etc.) no se les conoce como disoluciones.
Las mezclas de gases, tales como la atmósfera, a veces también se consideran como soluciones.
Las soluciones son distintas de los coloides y de las suspensiones en que las partículas del soluto son de tamaño molecular y están dispersas uniformemente entre las moléculas del solvente.
Las sales, los ácidos, y las bases se ionizan cuando se disuelven en el agua
Características de las soluciones (o disoluciones):
I) Sus componente no pueden separarse por métodos físicos simples como decantación, filtración, centrifugación, etc.
II) Sus componentes sólo pueden separase por destilación, cristalización, cromatografía.
III) Los componentes de una solución son soluto y solvente .
soluto es aquel componente que se encuentra en menor cantidad y es el que se disuelve. El soluto puede ser sólido, líquido o gas, como ocurre en las bebidas gaseosas, donde el dióxido de carbono se utiliza como gasificante de las bebidas. El azúcar se puede utilizar como un soluto disuelto en líquidos (agua).
solvente es aquel componente que se encuentra en mayor cantidad y es el medio que disuelve al soluto. El solvente es aquella fase en que se encuentra la solución. Aunque un solvente puede ser un gas, líquido o sólido, el solvente más común es el agua. (Ver: El agua como solvente ) .
IV) En una disolución, tanto el soluto como el solvente interactúan a nivel de sus componentes más pequeños (moléculas, iones). Esto explica el carácter homogéneo de las soluciones y la imposibilidad de separar sus componentes por métodos mecánicos.
Fermentación.
Fermentación.
La fermentación es un proceso catabólico de oxidación incompleta, que no requiere oxígeno, y el producto final es un compuesto inorgánico.
Según los productos finales existen diversos tipos de fermentación:
Fermentación Butanodiólica: La fermentación butanodiólica es una de las tres rutas que pueden seguir algunos grupos de bacterias fermentadoras con capacidad de generar hidrógeno a partir de azucares simples. En esta fermentación pueden generarse hasta 2 mol de Hidrógeno por Mol de glucosa además de otros productos de interés económicos como el butanodiol y el etanol.
Fermentación de butanodiol 2,3 es la fermentación anaeróbica de la glucosa con 2,3 butanodiol como uno de los productos finales. La estequiometría global de la reacción es:2 piruvato + NADH -> 2 CO 2 + 2,3 butanodiol
En esta fermentación se producen pequeñas cantidades de ácido que la fermentación de ácido mixto , y butanodiol, etanol y CO 2 yH 2 son los productos finales. Si bien la misma cantidad de CO 2 y H 2 se crean durante la fermentación ácido mixta, la fermentación butanodiol produce más del doble de la cantidad de CO 2 debido a que los gases no son producidos sólo por hidrógeno liasa formato como si estuvieran en la fermentación de ácido mixto.
Fermentación del ácido propiónico: las bacterias que presentan este tipo de fermentación se pueden utilizar tanto azúcares como lactato como puntos de partida para el proceso. La ruta es un proceso complejo en el que se genera acetato, CO2 y ácido propiónico como productos finales.
Esta ruta fermentativa la presentan las bacterias del tipo Propionibacterium y otras anaerobias estrictas presentes en el rumen de herbívoros donde llevan a cabo una fermentación secundaria de los productos de las fermentaciones lácticas primarias.
Industrialmente Propionibacterium es importante en la fermentación del queso para producir el tipo suizo: la fermentación propiónica utiliza en este caso el lactato producido en las fermentaciones lácticas primarias produciendo CO2 responsable de los «ojos» del queso suizo y acumulación de ácidos orgánicos de cadena corta responsables de características organolépticas.
Fermentación homoláctica: se denomina así la fermentación cuyo único producto final es el ácido láctico. Su ecuación global es:
Glucosa + 2 ADP + 2 Pi ® 2 ácido láctico + 2 ATP
Estas bacterias producen el piruvato por catabolismo de la glucosa siguiendo la ruta de Embden-Meyerhof (vía glucolítica clásica).
Es un proceso de fermentación presente en muchas bacterias del grupo láctico: Streptococcus (grupo de enterococos), Pediococcus y varios grupos de Lactobacillus.
Su importancia industrial estriba en la bajada del pH de los productos donde se encuentran estas bacterias: esta bajada del pH como consecuencia de la liberación de ácido láctico es suficiente para producir unos cambios químicos en el producto (precipitación de proteínas durante el cuajado de la leche), cambios microbiológico (protección del deterioro microbiano de alimentos como consecuencia de la eliminación de la flora competidora) y organolépticos (los ácidos orgánicos de cadena corta, y entre ellos el ácido láctico tienen características de producción de sabor) que hacen de esta fermentación un proceso muy relevante en la producción de alimentos.
La fermentación homoláctica es la causante de las agujetas producidas en los músculos después de un esfuerzo intenso en el que la cantidad de oxígeno aportada a las fibras musculares no es suficiente para asegurar toda la reoxidación del NADH+H+. Las agujetas se producen por los depósitos de ácido láctico entre las fibras musculares. Asimismo, la fermentación homoláctica es responsable de la alteración del esmalte dental en la boca causado por bacterias láctica flora habitual.
Fermentación heteroláctica: denominada así porque su producto final no es exclusivamente ácido láctico. El proceso tiene un rendimiento menor al de la fermentación homoláctica como se desprende de la producción de sólo un mol de ATP por mol de glucosa fermentada. La obtención del piruvato en estas bacterias se logra mediante el catabolismo de la glucosa por la ruta de las pentosas.
La reacción global es:
Glucosa + ADP + Pi ® Ac. láctico + etanol + CO2 + ATP
Este proceso lo llevan a cabo bacterias del grupo láctico pertenecientes a los géneros Leuconostoc y Lactobacillus.
Industrialmente el proceso es relevante en la producción de alimentos fermentados (por ejemplo el sauerkraut). Otra bacteria productora de este tipo de fermentación es Lactobacillus acidophilus que facilita el metabolismo de la leche.
Fermentación del butanol: es un tipo de fermentación llevado a cabo por bacterias anaerobias estrictas del género Clostridium. En el curso de esta fermentación se producen compuestos orgánicos disolventes de gran importancia industrial y que, históricamente, han sido los primeros productos industriales bacterianos de importancia económica relevante durante la 1ª Guerra Mundial (trabajo de Weizmann).
Proceso de Cristalización.
Proceso de Cristalización.
Cristalización es el nombre que se le da a un procedimiento de purificación usado en química por el cual se produce la formación de un sólido cristalino, a partir de un gas, un líquido o incluso, a partir de una disolución. En este proceso los iones, moléculas o átomos que forman una red en la cual van formando enlaces hasta llegar a formar cristales, los cuales son bastante usados en la química con la finalidad de purificar una sustancia de naturaleza sólida. Por medio de la cristalización se separa un componente de una solución en estado líquido pasándolo a estado sólido a modo de cristales que precipitan. Este paso u operación es necesaria para cualquier producto químico que se encuentre como polvos o cristales en el mundo comercial, por ejemplo, el azúcar, la sal, etc.
Proceso de Filtración.
Proceso de Filtración.
Se denomina filtración al proceso de separación de partículas sólidas de un líquido utilizando un material poroso llamado filtro. La técnica consiste en verter la mezcla sólido-líquido que se quiere tratar sobre un filtro que permita el paso del líquido pero que retenga las partículas sólidas.
El líquido que atraviesa el filtro se denomina filtrado.
El filtro, en el laboratorio suele ser papel poroso, pero puede ser de otros materiales que permitan el paso de líquidos. En cualquier caso es necesario seleccionar la porosidad del filtro según el diámetro de las partículas que se quieren separar.
Para más respuestas: Filtración
martes, 8 de noviembre de 2016
Química ambiental.
Química Ambiental.
La química ambiental, denominada también química medioambiental es la aplicación de la química al estudio de los problemas y la conservación del ambiente. Estudia los procesos químicos que tienen lugar en el medio ambiente global, o en alguna de sus partes: el suelo, los ríos y lagos, los océanos, la atmósfera, así como el impacto de las actividades humanas sobre nuestro entorno y la problemática que ello ocasiona. La química de la Atmósfera, a medida que la comunidad internacional presta más atención a las tesis del ecologismo(con acuerdos internacionales como el protocolo Kioto para reducir las emisiones de gases de efecto invernadero), es una disciplina que ha ido cobrando cada vez más importancia.
El desarrollo de esta disciplina mostró las graves consecuencias que tuvo para la capa de ozono el uso generalizado de los clorofluorocarbonos Tras las experiencias con la lluvia ácida la combinación de química medioambiental e ingeniería química resultó en el desarrollo de los tratamientos para limitar las emisiones de las fabricas.
También la química medioambiental se ocupa de los procesos, reacciones, evolución e interacciones que tienen lugar en las masas de agua continentales y marinas por el vertido de contaminantes antropológicos. Asimismo, estudia los tratamientos de dichos vertidos para reducir su carga dañina.
También hay interacción entre la llamada Química Sostenible o Química Verde y la preservación del ambiente, pues aquella estudia optimizar los procesos productivos químicos, eliminando productos secundarios, empleando condiciones menos agresivas (de presión y temperatura, de tipo de disolvente).
Destilación simple.
Destilación Simple.
Se llama destilación simple o destilación sencilla a un tipo de destilación donde los vapores producidos son inmediatamente canalizados hacia un condensador, el cual lo refresca y condensa de modo que el destilado no resulta puro. Su composición será idéntica a la composición de los vapores a la presión y temperatura dados.
La destilación sencilla, se usa para separar aquellos líquidos cuyos punto de ebullición difieren extraordinariamente (en más de 80°C aproximadamente) o para separar líquidos de sólidos no volátiles.
Para éstos casos, las presiones de los componentes del vapor normalmente son suficientemente diferentes de modo que la ley de Raoult puede descartarse debido a la insignificante contribución del componente menos volátil. En este caso, el destilado puede ser suficientemente puro para el propósito buscado.
martes, 25 de octubre de 2016
¿Qué es la Química Orgánica?
Química Orgánica.
La Química orgánica es la rama de la química que estudia una clase numerosa de moléculas que en su gran mayoría contienen carbono formando enlaces covalentes carbono-carbono o carbono-hidrógeno y otros heteroátomos también conocidos como compuestos orgánicos. Debido a la omnipresencia del carbono en los compuestos que esta rama de la química estudia esta disciplina también es llamada Química del carbono. Friedrich Wöhler es conocido como el padre de la Química orgánica por reportar la síntesis artificial de la urea a partir de Cianato de amonio: Compuesto Inorgánico con alto contenido de nitrógeno presente de manera general en la orina.
El Alma de la Química Orgánica: El Carbono.
La gran cantidad de compuestos orgánicos que existen tiene su explicación en las características del átomo de carbono, que tiene cuatro electrones en su capa de valencia: según la regla de octeto necesita ocho para completarla, por lo que forma cuatro enlaces(valencia = 4) con otros átomos. Esta especial configuración electrónica da lugar a una variedad de posibilidades de hibridación orbital del átomo de carbono (hibridación química).
La molécula orgánica más sencilla que existe es el metano. En esta molécula, el carbono presenta hibridación sp3, con los átomos de hidrógeno formando un tetraedro.
El carbono forma enlaces covalentes con facilidad para alcanzar una configuración estable, estos enlaces los forma con facilidad con otros carbonos, lo que permite formar frecuentemente cadenas abiertas (lineales o ramificadas) y cerradas (anillos).
Principales ramas de la química.
Las principales ramas de la química.
Debido a que la Química es una ciencia demasiado amplia, existen muchas ramas que pueden ser la bioquímica, la química-analítica, etc.
Ahora vamos a nombrar las principales ramas de la química:
-Química-analítica: Esta es la rama de la química que estudia, analiza, determina e identifica cualquier propiedad de un sistema químico.
Química-física: Esta es la rama de la química que se dedica al estudio de los procesos energéticos, magnéticos, mecánicos, ópticos y eléctricos en sistemas químicos como pueden ser los átomos, moléculas y cualquier partícula subatómica.
Química Industrial: Esta es la rama de la química que se dedica al estudio de los procesos que puedan producir productos en alta escala, es decir se dedican a investigar si pueden crear un producto para distribuir con una rentabilidad económica alta y ambiental.
Bioquímica: La bioquímica es la rama de la química que se dedica a la investigación de los seres vivos, esta rama de la química tiene mucha importancia dentro del mundo agrícola, ambiental y de la energía.
Estas unas de las ramas de la química más importantes, pero dentro de la química existen muchas más ramas que se dividen a su vez en otras ramas, es decir existe química pura y química aplicada y dentro de cada una de estas, hay estas ramas:
Química Aplicada:
Cristaloquímica: Esta rama de la química es la que investiga la composición química de la materia cristalina y estudia todas sus propiedades.
Química Farmacéutica: La química farmacéutica es la rama que estudia la estructura, la composición y las propiedades de los fármacos y es la encargada de profundizar entre las moléculas y el impacto biológico.
Quimiurgía: Esta rama es las aplicaciones de la química en la agricultura, esta tiene como finalidad usar materias primas en otras industrias.
Astro Química: Como su nombre indica, esta rama de la química estudia las composiciones de los astros, como pueden ser las estrellas, planetas, etc.
Ingeniería Química: Esta rama de la química es la que estudia y se dedica al diseño, investigación de sustancias, pero tan solo en procesos industriales y que tengan dependencia de procesos químicos.
Aparte de estas ramas de la química aplicada, también hay que añadir a la bioquímica que ya la explicamos antes.
Química pura:
Química Orgánica: A esta rama de la química mucha gente la llama la “Química del Carbono” y es la encargada de estudiar cualquier materia viva, es decir estudia todos los compuestos orgánicos.
Físico-Química: Esta es la rama de la química que está encargada del estudio de los fenómenos que tienen en común estas dos ciencias.
Química Preparativa: Cuando hablamos de química preparativa, hablamos de la rama de la química que esta especializada en la preparación y purificación de sustancias, con el único fin de crear productos nuevos.
Química inorgánica: Esta es la rama de la química encargada del estudio de la composición, estructura y las reacciones de cualquier elemento inorgánico y de todos sus compuestos (sin carbono).
Dentro de la química pura, también está la química-analítica de la que ya hablamos en el inicio del artículo.
De todas formas existen más ramas de la química como pueden ser:
Estequimétrica: Es la rama de la química que estudia todas las relaciones del volumen, la masa, el peso, etc. Es decir de cualquier sustancia que pueda participar en una reacción química.
Radioquímica: Esta es la rama que estudia y se encarga de las sustancias radiactivas.
Iatroquímica: Esta rama de la química tiene sus bases en la alquimia y es una rama de la química que tiene complicidad con la medicina, ya que tiene que ver con los procesos fisiológicos y con el cuerpo humano.
Tabla Periódica
Tabla Periódica de los Elementos Químicos.
La tabla periódica de los elementos es una disposición de los elementos químicos, en forma de tabla. Están ordenados por su número atómico, es decir, por su número de protones. Ademas, de su configuración de electrones, y sus propiedades químicas.
Las filas de la tabla se denominan periodos y las columnas se denominan grupos. Algunos grupos tienen nombres, como por ejemplo, el grupo 18 es el de los gases nobles. La tabla también se divide en cuatro bloques con algunas propiedades químicas similares.. Debido a que las posiciones están ordenadas, se puede utilizar la tabla para obtener relaciones entre las propiedades de los elementos, o pronosticar propiedades de elementos nuevos todavía no descubiertos o sintetizados.
Sin embargo, como se ve en la foto, este año se han integrado 4 nuevos elementos químicos. Pero lo fascinante de estos es que no provienen de la naturaleza. Estos han sido creados por el ser humano. Y ya tienen nombre:
”Moscovium”: Tendrá el símbolo Mc, y es el elemento número 115.
”Tennessine”: Tendrá el símbolo Ts y es el elemento número 117.
”Nihonium”: Tendrá el símbolo Nh y es el elemento número 113 (Nihon es una manera de decir Japón en japonés).
”Oganesson”: El elemento en honor al físico ruso Yuri Oganessian tendrá el símbolo Og y es el número 118.
martes, 18 de octubre de 2016
Laboratorio de Química.
Laboratorio de Química.
El laboratorio es un lugar dotado de los medios necesarios para realizar investigaciones, experimentos, prácticas y trabajos de carácter científico, tecnológico o técnico; está equipado con instrumentos de medida o equipos con los que se realizan experimentos, investigaciones o prácticas diversas, según la rama de la ciencia a la que se dedique. También puede ser un aula o dependencia de cualquier centro docente.
Su importancia, sea en investigaciones o a escala industrial y en cualquiera de sus especialidades (química, dimensional, electricidad, biología, etc.), radica en el hecho de que las condiciones ambientales están controladas y normalizadas, de modo que:
- Se puede asegurar que no se producen influencias extrañas (a las conocidas o previstas) que alteren el resultado del experimento o medición: control.
- Se garantiza que el experimento o medición es repetible, es decir, cualquier otro laboratorio podría repetir el proceso y obtener el mismo resultado: normalización.
La historia de los laboratorios está influida por la historia de la medicina, ya que el hombre, al profundizar acerca de cómo es su organismo, ha requerido el uso de laboratorios cada vez más especializados.
¿Qué es la Química?
La Química
Es la ciencia que estudia las diferentes formas y estructuras de la materia, sus propiedades, sus cambios, los procesos de transformación de la misma, las leyes que rigen esos cambios y los usos a los que se pueden destinar los distintos materiales. A la química se le puede consideran la ciencia central, ya que para los estudiantes de biología, física, ecología, geología y otras disciplinas, es esencial tener un conocimiento básico de química.
Suscribirse a:
Entradas (Atom)